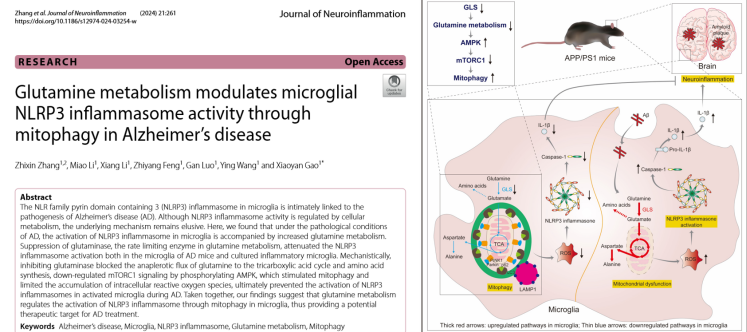
阿爾茨海默病(Alzheimer’s disease, AD)是一種典型的神經(jīng)退行性疾病,,小膠質(zhì)細(xì)胞介導(dǎo)的神經(jīng)炎癥是其主要病理特征之一,。小膠質(zhì)細(xì)胞中NLRP3炎性小體的激活與AD的發(fā)病機(jī)制密切相關(guān),但其具體活性調(diào)控分子機(jī)制仍不清楚,。北京中醫(yī)藥大學(xué)高曉燕教授團(tuán)隊(duì)創(chuàng)新性地從AD病理?xiàng)l件下小膠質(zhì)細(xì)胞內(nèi)代謝重編程與NLRP3炎癥小體之間的關(guān)系入手開展谷氨酰胺代謝調(diào)控AD神經(jīng)炎癥全過程機(jī)制闡釋,,為基于逆轉(zhuǎn)神經(jīng)炎癥的AD藥物研發(fā)提供新的靶點(diǎn)和思路。
該研究整合代謝組學(xué),、代謝流分析及分子生化多種研究方法,,發(fā)現(xiàn)Aβ能夠激活小膠質(zhì)細(xì)胞中NLRP3炎癥小體,并且在Aβ誘導(dǎo)的NLRP3炎性小體活化小膠質(zhì)細(xì)胞模型中和AD模型小鼠腦內(nèi)小膠質(zhì)細(xì)胞中的谷氨酰胺代謝顯著增強(qiáng),,而抑制谷氨酰胺限速酶GLS1表達(dá)能夠減輕NLRP3炎癥小體活性以及IL-1β和IL-18的產(chǎn)生,。進(jìn)一步研究發(fā)現(xiàn),,抑制GLS1酶活性能夠抑制谷氨酰胺回補(bǔ)代謝,阻礙細(xì)胞內(nèi)氨基酸合成,,造成細(xì)胞營養(yǎng)壓力,,誘導(dǎo)線粒體自噬,減少線粒體ROS積累,,進(jìn)而抑制NLRP3炎癥小體激活,,最終減輕AD小鼠腦內(nèi)小膠質(zhì)細(xì)胞介導(dǎo)的神經(jīng)炎癥反應(yīng)。該研究相關(guān)內(nèi)容以“Glutamine metabolism modulates microglial NLRP3 inflammasome activity through mitophagy in Alzheimer’s disease”為題發(fā)表于中科院一區(qū)期刊Journal of Neuroinflammation(https://jneuroinflammation.biomedcentral.com/articles/10.1186/s12974-024-03254-w#article-info),。北京中醫(yī)藥大學(xué)中藥學(xué)院博士后張志新為論文第一作者,,高曉燕教授為通訊作者。該項(xiàng)研究工作得到了國家自然科學(xué)基金(82104364, U21A20407)和北京市自然科學(xué)基金(7222276)的資助,。